 Равновесное состояние термодинамической системы определяется постоянством значений макроскопических величин, характеризующих это состояние. Обратимым называют такой термодинамический процесс А→B, который, будучи проведен в обратном направлении, возвращает систему в исходное состояние, проходя через те же промежуточные состояния в обратной последовательности, а состояние тел вне термодинамической системы остались неизменными. P А Обратимый В V А В Квазистатический – процесс, в ходе которого система все время остается в состоянии равновесия. Круговой D C
Равновесное состояние термодинамической системы определяется постоянством значений макроскопических величин, характеризующих это состояние. Обратимым называют такой термодинамический процесс А→B, который, будучи проведен в обратном направлении, возвращает систему в исходное состояние, проходя через те же промежуточные состояния в обратной последовательности, а состояние тел вне термодинамической системы остались неизменными. P А Обратимый В V А В Квазистатический – процесс, в ходе которого система все время остается в состоянии равновесия. Круговой D C
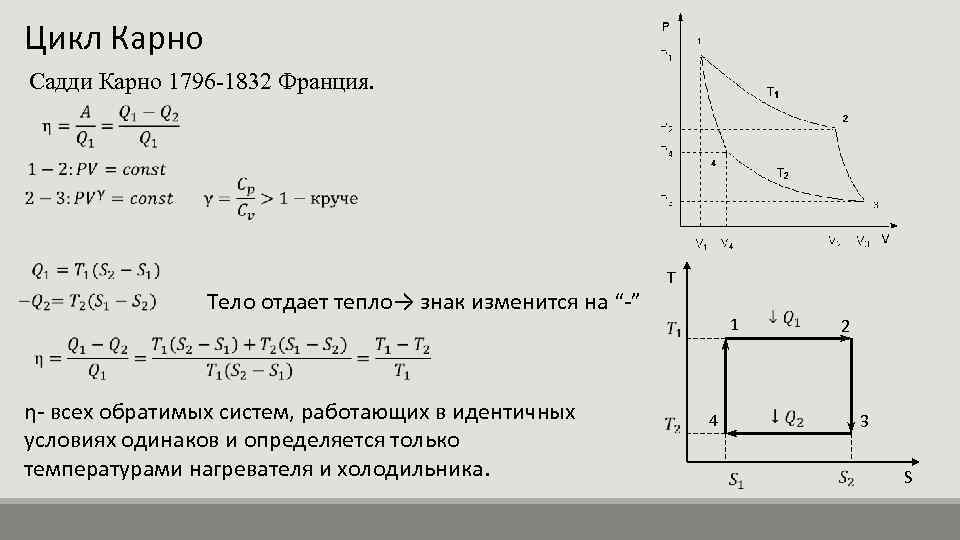 Цикл Карно Садди Карно 1796 -1832 Франция. Тело отдает тепло→ знак изменится на “-” η- всех обратимых систем, работающих в идентичных условиях одинаков и определяется только температурами нагревателя и холодильника. T 1 4 2 3 S
Цикл Карно Садди Карно 1796 -1832 Франция. Тело отдает тепло→ знак изменится на “-” η- всех обратимых систем, работающих в идентичных условиях одинаков и определяется только температурами нагревателя и холодильника. T 1 4 2 3 S
 При необратимом адиабатическом процессе энтропия возрастает η-любой необратимой машины всегда меньше, чем η обратимой, работающей в тех же условиях. Тепловая машина. 1 2 4 3
При необратимом адиабатическом процессе энтропия возрастает η-любой необратимой машины всегда меньше, чем η обратимой, работающей в тех же условиях. Тепловая машина. 1 2 4 3
 Предвестники 2 -ого начала термодинамики. Нельзя ли построить периодически действующую тепловую машину без холодильника? . Q 2=0 => такая машина превращала бы в работу всю теплоту, заимствованную от нагревателя. Закон сохранения энергии здесь не нарушается. Тогда представляется возможность создания вечного двигателя 2 -го рода (перпетуум мобиле 2 -го рода) => Заимствуем тепло из «неограниченного» (из океана, атмосферы, недров Земли) источника и превращаем его в работу. … тепло и вечный двигатель => Вильгельм Оствальд (1853 -1932 гг.)
Предвестники 2 -ого начала термодинамики. Нельзя ли построить периодически действующую тепловую машину без холодильника? . Q 2=0 => такая машина превращала бы в работу всю теплоту, заимствованную от нагревателя. Закон сохранения энергии здесь не нарушается. Тогда представляется возможность создания вечного двигателя 2 -го рода (перпетуум мобиле 2 -го рода) => Заимствуем тепло из «неограниченного» (из океана, атмосферы, недров Земли) источника и превращаем его в работу. … тепло и вечный двигатель => Вильгельм Оствальд (1853 -1932 гг.)
 Возможность совершения работы тепловыми двигателями обусловлена переходом тепла от тела более нагретому к телу менее нагретому.
Возможность совершения работы тепловыми двигателями обусловлена переходом тепла от тела более нагретому к телу менее нагретому.




 Энтропия, а для -приведенная теплота, является Но отношение функцией состояния системы - энтропия, где S- параметр состояния(как и P, V, T) В замкнутой или изолированной системе при протекании любого обратимого процесса энтропия остается неизменной
Энтропия, а для -приведенная теплота, является Но отношение функцией состояния системы - энтропия, где S- параметр состояния(как и P, V, T) В замкнутой или изолированной системе при протекании любого обратимого процесса энтропия остается неизменной
 При протекании в замкнутой термодинамической системе необратимого процесса, энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если, то какие либо изменения в системе без внешнего воздействия невозможны. - для обратимого процесса - для необратимого процесса Энтропия-мера отклонения реального процесса от идеального.
При протекании в замкнутой термодинамической системе необратимого процесса, энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если, то какие либо изменения в системе без внешнего воздействия невозможны. - для обратимого процесса - для необратимого процесса Энтропия-мера отклонения реального процесса от идеального.
 I-начало: II-начало: В замкнутой или изолированной системе при протекании необратим процесса энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если система находится в состоянии равновесия то какие либо изменения в системе без внешнего воздействия невозможны. Энтропия замкнутой системы может только возрастать. 1. Устанавливает наличие в природе фундаментальной асимметрии – однонаправленность всех самопроизвольно происходящих в природе процессов. 2. Количество энергии в замкнутых системах сохраняется, но распределение энергии меняется необратимым образом. III-начало: Если Т→ 0, то S→ 0, т. е. невозможно охладить вещество до температуры абсолютного нуля.
I-начало: II-начало: В замкнутой или изолированной системе при протекании необратим процесса энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если система находится в состоянии равновесия то какие либо изменения в системе без внешнего воздействия невозможны. Энтропия замкнутой системы может только возрастать. 1. Устанавливает наличие в природе фундаментальной асимметрии – однонаправленность всех самопроизвольно происходящих в природе процессов. 2. Количество энергии в замкнутых системах сохраняется, но распределение энергии меняется необратимым образом. III-начало: Если Т→ 0, то S→ 0, т. е. невозможно охладить вещество до температуры абсолютного нуля.

 - МАЛО! У реальных
- МАЛО! У реальных
 2. Клаузиус (1822 – 1888) в 1850 “ Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. ” Вообще “она” возможна. Но она невозможна при условии, что во всех остальных телах не произошло никаких изменений. Холодильник, но процесс не самопроизвольный, а сопровождается работой электрического мотора. 3. т. Нернста: энтропия любого тела стремится к нулю при Т → 0 Обратимый процесс - процесс, при котором система переходит из состояния А в В и возможно вернуть ее хотя бы одним способом в исходное состояние А и при том так, чтобы во всех остальных телах не произошло никаких изменений.
2. Клаузиус (1822 – 1888) в 1850 “ Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. ” Вообще “она” возможна. Но она невозможна при условии, что во всех остальных телах не произошло никаких изменений. Холодильник, но процесс не самопроизвольный, а сопровождается работой электрического мотора. 3. т. Нернста: энтропия любого тела стремится к нулю при Т → 0 Обратимый процесс - процесс, при котором система переходит из состояния А в В и возможно вернуть ее хотя бы одним способом в исходное состояние А и при том так, чтобы во всех остальных телах не произошло никаких изменений.
 Второе начало термодинамики. Направление термодинамических процессов в изолированной системе → к состояниям, вероятность которых максимальна: --Теплопередача => выравнивание температур. --Диффузия => однородный газ не может собраться в одной половинке сосуда. Энтропия. Статистический вес - число различных микросостояний, посредством которых осуществляется данное макросостояние w; Все макросостояния равновесны => вероятность макросостояния пропорциональна его статистическому весу. – энтропия – характеризует вероятность состояния термодинамической системы.
Второе начало термодинамики. Направление термодинамических процессов в изолированной системе → к состояниям, вероятность которых максимальна: --Теплопередача => выравнивание температур. --Диффузия => однородный газ не может собраться в одной половинке сосуда. Энтропия. Статистический вес - число различных микросостояний, посредством которых осуществляется данное макросостояние w; Все макросостояния равновесны => вероятность макросостояния пропорциональна его статистическому весу. – энтропия – характеризует вероятность состояния термодинамической системы.
 Невозможность вечного двигателя 2 -ого рода. Молекулы сами собрались в ½ части сосуда и, затем, за счет подводимого тепла изотермически расширяясь совершают работу: Вроде бы все хорошо, если бы молекулы действительно циклически собирались самопроизвольно в ½ части объема сосуда. А вот у тепловой машины энтропия возрастает! но т. к. , то
Невозможность вечного двигателя 2 -ого рода. Молекулы сами собрались в ½ части сосуда и, затем, за счет подводимого тепла изотермически расширяясь совершают работу: Вроде бы все хорошо, если бы молекулы действительно циклически собирались самопроизвольно в ½ части объема сосуда. А вот у тепловой машины энтропия возрастает! но т. к. , то
 Связь энтропии с вероятностью. Всякий процесс в природе протекает так, что система переходит в состояние, вероятность которого больше. Если система находится в состоянии с данной энтропией, то с подавляющей вероятностью следует ожидать, что она перейдет в состояние с большей энтропией, т. е. что наиболее вероятным изменением энтропии является ее возрастание. Но возможны и процессы с уменьшением энтропии – флуктуации ω в среднем росте.
Связь энтропии с вероятностью. Всякий процесс в природе протекает так, что система переходит в состояние, вероятность которого больше. Если система находится в состоянии с данной энтропией, то с подавляющей вероятностью следует ожидать, что она перейдет в состояние с большей энтропией, т. е. что наиболее вероятным изменением энтропии является ее возрастание. Но возможны и процессы с уменьшением энтропии – флуктуации ω в среднем росте.
Положение о необратимости процессов в природе (см. § 69), указывающее направление этих процессов, представляет собой одно из общих выражений второго начала термодинамики. Более конкретную формулировку и математическое выражение второго начала можно получить из рассмотрения так называемого цикла Карно, с которым мы познакомимся, введя предварительно понятие о круговом процессе.
Круговым процессом, или циклом, называется процесс, в результате которого система, пройдя через ряд состояний, возвращается в исходное состояние. Очевидно, что на графике круговой процесс изобразится замкнутой кривой линией (рис. 138). Работа А у совершаемая при круговом
процессе, численно равна площади ограниченной этой замкнутой линией. Поясним данное утверждение, полагая для определенности, что системой является некоторая масса газа. Цикл состоит из двух последовательных процессов: расширения и сжатия газа. В соответствии с графическим представлением работы, рассмотренным в § 70 (см. рис. 135), работа А и совершаемая газом при расширении, выразится площадью фигуры эта работа положительна (см. § 69). На тех же основаниях работа совершаемая при сжатии газа, выразится площадью фигуры и будет отрицательной. Тогда работа, совершенная при круговом процессе,
![]()
и выразится разностью площадей фигур и т. е. площадью фигуры, ограниченной замкнутой линией Если круговой процесс идет по часовой стрелке , то работа будет положительной (так как если же круговой процесс идет против часовой стрелки отрицательной (так как ).

Если в результате цикла совершается некоторая работа то система, периодически повторяющая такой цикл, называется машиной.
В 1824 г. французский инженер Сади Карно теоретически рассмотрел работу идеальной тепловой машины, состоящей из одного моля идеального газа (рабочее тело), заключенного в цилиндр под поршнем, нагревателя и холодильника. Эта система периодически совершает обратимые циклы, состоящие из двух изотермических и двух адиабатических процессов (рис. 139). Стенки цилиндра и поршень абсолютно нетеплопроводны, а дно цилиндра абсолютно теплопроводно. Однако с помощью абсолютно нетеплопроводной крышки прикладываемой ко дну цилиндра, можно было сделать весь цилиндр абсолютно нетеплопроводным. Трение и тепловые потери в системе полностью отсутствуют.
Проследим за работой этой идеальной тепловой машины, получившей название цикла Карно. Изменения состояния системы будем изображать на диаграмме, а положения поршня в цилиндре - на схеме (см. рис. 139).
1. Газ находится в сжатом состоянии поршень - в положении 1. Чтобы обеспечить изотермическое расширение газа, приведем дно цилиндра в тепловой контакт с нагревателем находящимся при температуре
2. Когда газ расширится до состояния уберем нагреватель и, закрыв дно крышкой предоставим газу возможность
закончить расширение адиабатически до состояния Совершая работу по расширению, газ охладится; поэтому
3. Чтобы завершить цикл, т. е. вернуть газ в начальное состояние а поршень - в исходное положение 7, необходимо совершить внешнюю работу сжатия газа. Будем сначала сжимать газ изотермически до состояния заменив крышку холодильника X (при температуре Причем состояние 4 надо выбрать заранее, с таким расчетом, чтобы из него по адиабате 4-1 можно было перевести газ в начальное состояние 1.
4. Завершим сжатие газа до начального состояния адиабатически, заменив холодильник крышкой
Цикл закончен и может быть затем многократно повторен. На участке 1 2 газ совершил работу по изотермическому расширению, получив от нагревателя количество теплоты На участке газ совершил работу по адиабатическому расширению за счет своей внутренней энергии. На участке 3-4 внешние силы совершили работу по изотермическому сжатию газа; при этом он отдал холодильнику количество теплоты Наконец, на участке 4 внешние силы совершили работу по адиабатическому сжатию газа, повысив его внутреннюю энергию.
Так как газ вернулся в первоначальное состояние, то изменение его внутренней энергии Тогда, согласно первому началу термодинамики [формула (1)], полученное газом в результате всего цикла количество теплоты должно равняться совершенной им за время цикла работе:
Нетрудно показать, что по абсолютной величине Действительно, оба адиабатических процесса осуществлялись в одном и том же интервале температур Тогда, согласно формуле (13), будут одинаковыми и совершаемые при этих процессах работы. Поэтому формула (14) примет вид
где - суммарная работа, совершаемая за весь цикл и численно равная площади 1234, ограниченной графиком цикла. Так как цикл проводился по часовой стрелке, то эта работа положительна. Итак, в результате цикла газ, получив количество теплоты от нагревателя и передав часть этого количества теплоты холодильнику, совершил внешнюю работу, равную
![]()
Зададимся вопросом: может ли рассматриваемая тепловая машина совершать работу только за счет получения количества теплоты от нагревателя, не отдавая части количества теплоты
холодильнику? Иными словами, можно ли теплоту целиком превращать в работу? Очевидно, что при отсутствии холодильника процесс можно было бы замкнуть (т. е. получить цикл) только посредством обратного процесса Площадь такого цикла, а следовательно, и совершаемая работа будут равны нулю. Таким образом, отдача части теплоты холодильнику является необходимым условием совершения работы. Но тогда, согласно формуле (16),
т. е. рассматриваемая тепловая машина не может все полученное количество теплоты целиком переводить в работу. Как показывают опыт и выводы из всей термодинамики, это невозможно не только для данной машины, но и вообще.

Невозможен механизм, который все получаемое от нагревателя количество теплоты целиком переводил бы в работу; часть этого количества теплоты должна быть отдана холодильнику.
Это утверждение является одной из формулировок второго начала термодинамики, а формулы (16) и (17) - его математическими выражениями. Таким образом, тепловая машина должна работать по схеме, представленной на рис. 140.
Воображаемый механизм, превращающий все количество теплоты в работу, называется вечным двигателем второго рода. Его осуществление дало бы человечеству неисчерпаемый источник энергии, поскольку запасы теплоты на Земле практически неограниченны. За счет одного только количества теплоты, содержащегося в воде морей и океанов можно было бы с помощью вечного двигателя второго рода приводить в движение машины всех фабрик и заводов в течение многих тысячелетий. Причем за первые 1700 лет такой «перекачки» теплоты температура воды в океане понизилась бы в среднем только на одну сотую долю кельвина.
Второе начало термодинамики – теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. Под теплотой понимается внутренняя энергия тела.
Рассмотрим систему, способную контактировать с двумя тепловыми резервуарами. Температуры резервуаров (нагреватель) и (холодильник) .. В первоначальном состоянии (поз. 1) температура системы . Приведем ее в тепловой контакт с нагревателем и, квазистатически уменьшив давление, увеличим объем.
Система перешла в состояние с той же температурой , но с большим объемом и меньшим давлением (поз. 2). При этом системой была выполнена работа , а нагреватель передал ей количество теплоты . Далее уберем нагреватель и квазистатически по адиабате переведем систему в состояние с температурой (поз. 3). При этом система выполнит работу . Затем приведем систему в контакт с холодильником и вказистатически уменьшим объем системы. Количество тепла , которое при этом выделит система, поглотится холодильником – ее температура останется прежней.Над системой была выполнена работа (или система выполнила отрицательную работу– ). Состояние системы (поз. 4) выбирается таким, чтобы можно было по адиабате вернуть систему в исходное состояние (поз 1). При этом система выполнит отрицательную работу Т.к. система вернулась в исходное состояние, то внутренняя энергия после цикла осталась прежней, но при этом системой была выполнена работа . Из этого следует, что изменения энергии при выполнении работы компенсировались нагревателем и холодильником. Значит ![]() , – количество теплоты, которая пошла на выполнение работы .Коэффициент полезного действия
(КПД) определяется по формуле:
, – количество теплоты, которая пошла на выполнение работы .Коэффициент полезного действия
(КПД) определяется по формуле:
![]() .
.
Отсюда следует, что .
Теорема Карно
гласит, что
коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур и нагревателя и холодильника, но не зависит от устройства машины, а также от вида рабочего вещества.
Вторая теорема Карно гласит – коэффициент полезного действия всякой тепловой машины не может превосходить коэффициент полезного действия идеальной машины, работающей по циклу Карно с теми же самыми температурами нагревателя и холодильника.
Неравенство Клаузиуса:
Из него видно, что количество теплоты, которое получила система при круговом процессе, отнесенное к абсолютной температуре, при которой происходил процесс, есть величина неположительная. Если процесс квазистатический, то неравенство переходит в равенство:
Это значит, что приведенное количество теплоты, получаемое системой при любом квазистатическом круговом процессе, равно нулю .
– элементарное приведенное количество теплоты, получаемое в бесконечно
малом процессе.
– элементарное приведенное количество теплоты, получаемое в конечном
процессе.
Энтропия системы есть функция ее состояния, определенная с точностью до произвольной постоянной.
Разность энтропий
в двух равновесных состояниях и , по определению, равна приведенному количеству теплоты, которое надо сообщить системе, чтобы перевести ее из состояния в состояние по любому квазистатическому пути.
Энтропия выражается функцией:
.
 Предположим, что система переходит из равновесного состояния в равновесное состояние по пути , и переход – необратимый (штрихованная). Систему в квазистатически можно вернуть в исходное состояние по другому пути . Опираясь на неравенство Клаузиуса можно написать:
Предположим, что система переходит из равновесного состояния в равновесное состояние по пути , и переход – необратимый (штрихованная). Систему в квазистатически можно вернуть в исходное состояние по другому пути . Опираясь на неравенство Клаузиуса можно написать:
Лекция 13 .
Тепловые и холодильные машины. Второе начало термодинамики. Цикл Карно. Теорема Карно. Термодинамическая шкала температур. Неравенство Клаузиуса. Термодинамическая энтропия. Закон возрастания энтропии. Третье начало термодинамики.
Тепловые машины или тепловые двигатели , предназначены для получения полезной работы за счет теплоты, выделяемой вследствие химических реакций (сгорания топлива), ядерных превращений или по другим причинам. Для функционирования тепловой машины обязательно необходимы следующие составляющие: нагреватель, холодильник и рабочее тело .
Х олодильником может являться, например, окружающая среда.
В дальнейшем будет применяться понятие термостата , под которым подразумевается тело, находящееся при постоянной температуре и обладающее бесконечной теплоёмкостью – любые процессы получения или отдачи теплоты не меняют температуру этого тела.
Циклический (круговой) термодинамический процесс.
Р ассмотрим
циклический процесс, в котором нагреватель
передает рабочему телу теплоту Q
Н
.
Рабочее тело совершает работу и затем
отдаёт тепло холодильнику Q
Х
.
ассмотрим
циклический процесс, в котором нагреватель
передает рабочему телу теплоту Q
Н
.
Рабочее тело совершает работу и затем
отдаёт тепло холодильнику Q
Х
.
Замечание . Наличие штриха означает. что берётся абсолютное значение указанной величины, т.е. Q Х = Q Х .
Такой круговой процесс называется прямым . В прямом процессе теплота забирается у более нагретого тела и после совершения системой работы над внешними телами остаток теплоты отдаётся менее нагретому телу. Тепловые машины работают по прямому циклу.
Процесс, в котором теплота забирается у менее нагретого тела и отдаётся более нагретому телу в результате совершения работы над системой внешними телами, называется обратным. По обратному циклу работают холодильные машины .
Теплота, полученная системой, считается положительной Q Н > 0 , а отданная – отрицательной Q Х < 0 . Если Q Х > 0 – теплота, полученная холодильником , то можно записать:
Q Х = Q Х = Q Х .
Внутренняя энергия – это функция состояния, поэтому при круговом (циклическом) процессе, когда система возвращается в исходное состояние, внутренняя энергия не изменяется. Из первого начала термодинамики следует:
Но так как
 ,
то
,
то
так как
 ,
,
 .
.
Коэффициент полезного действия (термический кпд) прямого цикла:
определяется для циклических (повторяемых) процессов. (Для нециклического процесса подобное отношение называется полезным выходом .)
Замечание . Передача теплоты холодильнику является обязательной для циклического процесса. Иначе рабочее тело придёт в тепловое равновесие с нагревателем, и передача теплоты от нагревателя будет невозможной. Поэтому КПД любой тепловой машины всегда меньше единицы:
 .
.
В холодильной машине внешние тела совершают работу А внеш по отводу теплоты Q 2 от охлаждаемого тела и передаче теплоты Q 1 тепловому резервуару (обычно – это окружающая среда). КПД холодильной машины или холодильный коэффициент – это отношение отведённого количества теплоты к затраченной работе:
 .
.
Вообще говоря, этот коэффициент может быть как меньше единицы, так и больше единицы – всё зависит от работы внешних тел.
Тепловой насос
- устройство, «перекачивающее» теплоту
от холодных тел к нагретым и предназначенное,
например, для обогрева помещения. При
этом теплота
 отбирается у окружающей среды, имеющей
меньшую температуру, и воздуху в помещении
отдаётся теплота
отбирается у окружающей среды, имеющей
меньшую температуру, и воздуху в помещении
отдаётся теплота
 .
Тепловой насос работает по обратному
тепловому циклу. (Этот принцип обогрева
называется динамическим отоплением).
КПД теплового насоса
равен отношению теплоты, переданной
помещению, к затраченной работе:
.
Тепловой насос работает по обратному
тепловому циклу. (Этот принцип обогрева
называется динамическим отоплением).
КПД теплового насоса
равен отношению теплоты, переданной
помещению, к затраченной работе:
 .
.
Так как теплота, отводимая от окружающей
среды больше нуля, то КПД теплового
насоса больше единицы. Но для КПД этого
же прямого цикла
 ,
,
 ,
поэтому
,
поэтому
 ,
,
т.е. КПД теплового насоса равен обратной величине КПД прямого цикла .
Второе начало (закон) термодинамики. Энтропия. Цикл Карно.
Круговые процессы (циклы)
Первый закон термодинамики утверждает, что теплота может превращаться в работу, а работа в теплоту и не устанавливает условий, при которых возможны эти превращения.
Превращение работы в теплоту происходит всегда полностью и безусловно. Обратный процесс превращения теплоты в работу при непрерывном её переходе возможен только при определенных условиях и не полностью. Теплота сам собой может переходить только от более нагретых тел к холодным. Переход теплоты от холодных тел к нагретым сам собой не происходит. Для этого нужно затратить дополнительную энергию.
Таким образом, для полного анализа явления и процессов необходимо иметь кроме первого закона термодинамики еще дополнительную закономерность. Этим законом является второй закон термодинамики. Он устанавливает, возможен или невозможен тот или иной процесс, в каком направлении протекает процесс, когда достигается термодинамическое равновесие и при каких условиях можно получить максимальную работу.
Формулировки второго закона термодинамики.
Для существования теплового двигателя необходимы два источника - горячий источник и холодный источник (окружающая среда). Если тепловой двигатель работает только от одного источника, то он называется вечным двигателем 2-го рода.
Первая формулировка (Оствальда):
"вечный двигатель 2-го рода невозможен".
Вечный двигатель первого рода это тепловой двигатель, у которого L>Q1, где Q1 - подведенная теплота. Первый закон термодинамики "позволяет" возможность создать тепловой двигатель, полностью превращающий подведенную теплоту Q1в работу L, т.е. L = Q1. Второй закон накладывает более жесткие ограничения и утверждает, что работа должна быть меньше подведенной теплоты (L Вечный двигатель 2-го рода можно осуществить, если теплоту Q2 передать от холодного источника к горячему. Но для этого теплота самопроизвольно должна перейти от холодного тела к горячему, что невозможно. Отсюда следует вторая формулировка (Клаузиуса): "теплота не может самопроизвольно переходит от более холодного тела к более нагретому". Для работы теплового двигателя необходимы два источника - горячий и холодный. Третья формулировка (Карно): "там где есть разница температур, возможно совершение работы". Все эти формулировки взаимосвязаны, из одной формулировки можно получить другую. Одной из функций состояния термодинамической системы является энтропия. Энтропией называется величина, определяемая выражением: dS = ?Q / T. [Дж/К] (7) или для удельной энтропии: ds = ?q /T [Дж/(кг·К)] (8) Энтропия есть однозначная функция состояния тела, принимающая для каждого состояния вполне определенное значение. Она является экстенсивным (зависит от массы вещества) параметром состояния и в любом термодинамическом процессе полностью определяется начальным и конечным состоянием тела и не зависит от пути протекания процесса. Энтропию можно определить как функцию основных параметров состояния: S = f1(P,V); S = f2(P,T); S = f3(V,T); (9) или для удельной энтропии: s = f1(P,v); s = f2(P,T); S = f3(v,T); (10) Так как энтропия не зависит от вида процесса и определяется начальными и конечными состояниями рабочего тела, то находят только её изменение в данном процессе, по следующим уравнениям: S = cv·ln(T2/T1) + R?·ln(v2/v1); (11) S = cp·ln(T2/T1) - R?·ln(P2/P1); (12) S = cv·ln(Р2/Р1) + cр·ln(v 2/v 1). (13) Если энтропия системы возрастает (?s > 0), то к системе подводится тепло. Если энтропия системы уменьшается (?s < 0), то от системы отводится тепло. Если энтропия системы не изменяется (?s = 0, s = сonst), то к системе не подводится и от неё не отводится тепло (адиабатный процесс или изоэнтропный процесс). Термодинамическим процессом называют переход системы из одного равновесного состояния в другое. Если система в результате совершения нескольких процессов приходит в первоначальное состояние, то говорят, что она совершила замкнутый процесс или цикл. Циклом Карно называется круговой цикл, состоящий из 2-х изотермических (протекающих при постоянной температуре) и из 2-х адиабатных процессов (протекающих без теплообмена с окружающей средой). Обратимый цикл Карно в p-v- и T-s- диаграммах показан на рис.1: 1-2 - обратимое адиабатное расширение при s1=сonst. Температура уменьшается от Т1 до Т2. 2-3 - изотермическое сжатие, отвод теплоты q2 к холодному источнику от рабочего тела. 3-4 - обратимое адиабатное сжатие при s2=сonst. Температура повышается от Т3 до Т4. 4-1 - изотермическое расширение, подвод теплоты q1 к горячего источника к рабочему телу. Основной характеристикой любого цикла является термический коэффициент полезного действия (т.к.п.д.). T = Lц / Qц, (14) или?t = (Q1 - Q2) / Q1. Рис.1.
Для обратимого цикла Карно термический к.п.д. определяется по формуле: Tк = (Т1 - Т2) / Т1. (15) Отсюда следует первая теорема Карно: "термический к.п.д. обратимого цикла Карно не зависит от свойств рабочего тела и определяется только температурами источников". Из сравнения произвольного обратимого цикла и цикла Карно вытекает 2-я теорема Карно: "обратимый цикл Карно является наивыгоднейшим циклом в заданном интервале температур" Следовательно, термический к.п.д. цикла Карно всегда больше термического к.п.д. произвольного цикла: Tк > ?t. (16) Дальнейшие работы по термодинамике показали, что энтропия имеет глубокий физический смысл. В необратимых процессах она возрастает и достигает максимума, когда система приходит в состояние теплового равновесия. Например, в Солнечной системе, согласно второму закону термодинамики, идут процессы, приводящие к возрастанию энтропии. Происходит рассеяние энергии Солнца, что в конечном итоге приведёт Солнечную систему в состояние теплового равновесия с очень низкой температурой. Клаузиус назвал это явление тепловой смертью Солнечной системы. Он же распространил этот вывод и на всю Вселенную и предсказал тепловую смерть Вселенной. Однако данные астрофизики последних десятилетий показывают, что во Вселенной идут процессы, противоречащие второму закону термодинамики. В отдельных её частях вспыхивают сверхновые звёзды, т.е. идут процессы с уменьшением энтропии, что противоречит второму началу. Следовательно, второй закон термодинамики нельзя распространять на всю Вселенную, как это сделал Клаузиус.
