Алкены — это непредельные углеводороды , которые имеют одну двойную связь между атомами . Другое их название это олефины, оно связано с историей открытия этого класса соединений. В основном в природе эти вещества не встречаются, а синтезируются человеком для практических целей. В номенклатуре ИЮПАК название этих соединений формируется по тому же принципу, что и для алканов, только суффикс “ан” заменяется на “ен”.
Вконтакте
Строение алкенов
Два атома углерода, участвующих в образовании двойной связи, всегда находятся в sp2 гибридизации, и угол между ними равен 120 градусам. Двойная связь образована с помощью перекрывания π -π орбиталей, а оно не очень прочное, поэтому данную связь достаточно просто разорвать, что находит применение в химических свойствах веществ.
Изомерия
По сравнению с предельными, в этих углеводородах возможно больше видов , при том как пространственной, так и структурной. Структурная изомерия может также подразделяться на несколько видов.
Первый также существует и для алканов, и заключается в различном порядке соединения атомов углерода. Так изомерами могут быть пентен-2 и 2-метилбутен-2. А второй — это изменение положения двойной связи.
Пространственная изомерия в этих соединениях возможна благодаря появлению двойной связи. Она бывает двух видов — геометрической и оптической.
Геометрическая изомерия — один из самых распространенных в природе видов, при том практически всегда геометрические изомеры будут иметь кардинально разные физические и химические свойства. Различают цис и транс изомеры. У первых — заместители располагаются с одной стороны от кратной связи, а у транс изомеров они находятся в разных плоскостях.
Получение алкенов
 Впервые получены они были, как и много других веществ, совершенно случайно.
Впервые получены они были, как и много других веществ, совершенно случайно.
Немецкий химик и исследователь Бехер в конце 17 века изучал действие серной кислоты на этиловый спирт и понял, что получил неизвестный газ , который при этом является более реакционноспособным, чем метан.
Позже подобные исследования провели еще несколько ученых, они же и узнали, что данный газ при взаимодействии с хлором образует маслянистое вещество.
Поэтому первоначально этому классу соединений было присвоено название олефины, что переводится как маслородный. Но все же определить состав и строение данного соединения у ученых не получалось. Это произошло только почти спустя два века, в конце девятнадцатого столетия.
В настоящее время существует много способов получения алкенов.
Промышленные способы
Получение промышленными методами :
- Дегидрирование предельных углеводородов. Данная реакция возможна только при действии высоких температур (около 400 градусов) и катализаторов — либо оксида хрома 3, либо алюмоплатиновых катализаторов.
- Дегалогенирование дигалогеноалканов. Происходит только в присутствии цинка или магния, и при высоких температурах.
- Дегидрогалогенирование галогеноалканов. Проводится при помощи натриевых или калиевых солей органических кислот при повышенной температуре.
Важно ! Данные способы получения алкенов не дают чистого продукта, результатом реакции будет смесь непредельных углеводородов. Преобладающее среди них соединение определяется с помощью правила Зайцева. Оно гласит, что водород отщепляется с наибольшей вероятностью от атома углерода у которого меньше всего связей с водородами.
Дегидратация спиртов. Может проводиться только при нагревании и в присутствии растворов сильных минеральных кислот, обладающих водоотнимающим свойством.
Гидрирование алкинов. Возможно только в присутствии паладиевых катализаторов.
Химические свойства алкенов
Алкены являются очень химически активными веществами. Во многом это объясняется благодаря наличию двойной связи. Самыми характерными реакциями для этого класса соединений являются электрофильное и радикальное присоединение.
- Галогенирование алкенов — относится к классическим реакциям электрофильного присоединения. Она происходит только в присутствии инертных органических растворителей, чаще всего это тетрахлорметан.
- Гидрогалогенирование. Присоединение этого типа осуществляется по правилу Марковникова. Ион присоединяется к более гидрированному атому углерода возле двойной связи, и соответственно, ион галогенида присоединяется ко второму атому углерода. Это правило нарушается в присутствии перекисных соединений — эффект Харроша. Присоединение галогеноводорода происходит полностью обратно правилу Марковникова.
- Гидроборирование. Эта реакция имеет значительную практическую важность. Поэтому ученый, который ее открыл и изучил даже получил Нобелевскую премию. Данная реакция проводится в несколько ступеней, при этом присоединение иона бора происходит не по правилу Марковникова.
- Гидратация алкенов или присоединение . Данная реакция также протекает согласно правилу Марковникова. Гидроксид-ион присоединяется к наименее гидрированному атому углерода при двойной связи.
- Алкилирование — еще одна реакция часто применяемая в промышленности. Она заключается в присоединении предельных углеводородов к непредельным под воздействием низких температур и катализаторов, с целью увеличения атомной массы соединений. Катализатором чаще всего выступают сильные минеральные кислоты. Также эта реакция может протекать и по свободнорадикальному механизму.
- Полимеризация алкенов — еще одна нехарактерная для предельных углеводородов реакция. Она подразумевает соединение между собой многочисленных молекул с целью образования прочного соединения, отличающегося по своим физическим свойствам.
 n в данной реакции это количество молекул, вступивших в связь. Обязательным условием осуществления является кислая среда, повышенная температура и увеличенное давление.
n в данной реакции это количество молекул, вступивших в связь. Обязательным условием осуществления является кислая среда, повышенная температура и увеличенное давление.
Также для алкенов характерны и другие реакции электрофильного присоединения, которые не получили такого обширного практического распространения.
Например, реакция присоединения спиртов, с образованием простых эфиров.
Или присоединение хлорангидридов, с получением непредельных кетонов — реакция Кондакова.
Обратите внимание! Данная реакция возможна только в присутствии катализатора хлорида цинка.
Следующий крупный класс реакций характерный для алкенов это реакции радикального присоединения. Данные реакции возможны только при образовании свободных радикалов под воздействием высоких температур, облучения и других действий. Самая характерная реакция радикального присоединения это гидрирование с образованием предельных углеводородов. Она происходит исключительно под воздействием температур и в присутствии платинового катализатора.
Благодаря наличию двойной связи, для алкенов очень характерными являются различные реакции окисления .
- Горение — классическая реакция окисления. Она хорошо идет без катализаторов. В зависимости от количества кислорода возможны разные конечные продукты: от углекислого газа и до углерода.
- Окисление перманганатом калия в нейтральной среде. Продуктами являются многоатомные спирты и бурый осадок диоксида марганца. Данная реакция считается качественной для алкенов.
- Также мягкое окисление может осуществляться пероксидом водорода, оксидом осмия 8, и другими окислителями в нейтральной среде. Для мягкого окисления алкенов характерен разрыв только одной связи, продуктом реакции, как правило, являются многоатомные спирты.
- Также возможно и жесткое окисление, при котором происходит разрыв обеих связей и образуются кислоты или кетоны. Обязательным условием является кислая среда, чаще всего используют серную кислоту, так как другие кислоты могут также подвергаться окислению с образованием побочных продуктов.
Алкены ненасыщенные алифатические углеводороды с одной или несколькими двойными углерод-углеродными связями. Двойная связь превращает два атома углерода в плоскую структуру с валентными углами между соседними связями по 120°С:
Гомологический ряд алкенов имеет общую формулу двумя его первыми членами являются этен (этилен) и пропен (пропилен):

Члены ряда алкенов с четырьмя или большим числом атомов углерода обнаруживают изомерию положения связей. Например, алкен с формулой имеет три изомера, два из которых являются изомерами положения связей:
Заметим, что нумерация цепи алкенов производится с того ее конца, который ближе к двойной связи. Положение двойной связи указывается меньшим из двух номеров, которые соответствуют двум атомам углерода, связанным между собой двойной связью. Третий изомер имеет разветвленную структуру:

Число изомеров какого-либо алкена возрастает с числом атомов углерода. Например, гексен имеет три изомера положения связей:
диенов является бута-1,3-диен, или просто бутадиен:
Соединения, содержащие три двойные связи, называются триенами. Соединения с несколькими двойными связями имеют общее название полиены.
Физические свойства
Алкены имеют несколько более низкие температуры плавления и кипения, чем соответствующие им алканы. Например, пентан имеет температуру кипения . Этилен, пропен и три изомера бутена при комнатной температуре и нормальном давлении находятся в газообразном состоянии. Алкены с числом атомов углерода от 5 до 15 в нормальных условиях находятся в жидком состоянии. Их летучесть, как и у алканов, возрастает при наличии разветвления в углеродной цепи. Алкены с числом атомов углерода больше 15 при нормальных условиях представляют собой твердые вещества.
Получение в лабораторных условиях
Двумя основными способами получения алкенов в лабораторных условиях являются дегидратация спиртов и дегидрогалогенирование галогеноалканов. Например, этилен можно получить дегидратацией этанола при действии избытка концентрированной серной кислоты при температуре 170 °С (см. разд. 19.2):
Этилен можно также получить из этанола, пропуская пары этанола над поверхностью нагретого оксида алюминия. Для этой цели можно использовать установку, схематически изображенную на рис. 18.3.
Второй распространенный метод получения алкенов основан на проведении дегидрогалогенирования галогеноалканов в условиях основного катализа
Механизм реакции элиминирования такого типа описан в разд. 17.3.
Реакции алкенов
Алкены обладают намного большей реакционной способностью, чем алканы. Это обусловлено способностью -электронов двойной связи притягивать электрофилы (см. разд. 17.3). Поэтому характерные реакции алкенов представляют собой главным образом реакции электрофильного присоединения по двойной связи:

Многие из этих реакций имеют ионные механизмы (см. разд. 17.3).
Гидрирование
Если какой-нибудь алкен, например этилен, смешать с водородом и пропустить эту смесь над поверхностью платинового катализатора при комнатной температуре или никелевого катализатора при температуре около 150°С, то произойдет присоединение
водорода по двойной связи алкена. При этом образуется соответствующий алкан:

Реакция этого типа представляет собой пример гетерогенного катализа. Его механизм описан в разд. 9.2 и схематически показан на рис. 9.20.
Присоединение галогенов
Хлор или бром легко присоединяются по двойной связи алкена; эта реакция протекает в неполярных растворителях, например в тетрахлорометане или гексане. Реакция протекает по ионному механизму, который включает образование карбкатиона. Двойная связь поляризует молекулу галогена, превращая ее в диполь:

Поэтому раствор брома в гексане или тетрахлорометане при встряхивании с алкеном обесцвечивается. То же самое происходит, если встряхивать алкен с бромной водой. Бромная вода представляет собой раствор брома в воде. Этот раствор содержит бромноватистую кислоту . Молекула бромноватистой кислоты присоединяется по двойной связи алкена, и в результате образуется бромозамещенный спирт. Например

Присоединение галогеноводородов
Механизм реакции этого типа описан в разд. 18.3. В качестве примера рассмотрим присоединение хлороводорода к пропену:
Отметим, что продукт этой реакции представляет собой 2-хлоропропан, а не 1-хлоро-пропан:
![]()
В таких реакциях присоединения наиболее электроотрицательный атом или наиболее электроотрицательная группа всегда присоединяются к атому углерода, связанному с
наименьшим числом атомов водорода. Эта закономерность носит название правила Марковникова.
Предпочтительное присоединение электроотрицательного атома или группы к атому углерода, связанному с наименьшим числом атомов водорода, обусловлено повышением устойчивости карбкатиона по мере возрастания числа алкильных заместителей на атоме углерода. Это повышение устойчивости в свою очередь объясняется индуктивным эффектом, возникающим в алкильных группах, так как они являются донорами электронов:

В присутствии какого-либо органического пероксида пропен реагирует с бромоводородом, образуя т. е. не по правилу Марковникова. Такой продукт называется антимарковниковским. Он образуется в результате протекания реакции по радикальному, а не ионному механизму.
Гидратация
Алкены реагируют с холодной концентрированной серной кислотой, образуя алкил-гидросульфаты. Например

Эта реакция представляет собой присоединение, поскольку в ней происходит присоединение кислоты по двойной связи. Она является обратной реакцией по отношению к дегидратации этанола с образованием этилена. Механизм этой реакции подобен механизму присоединения галогеноводородов по двойной связи. Он включает образование промежуточного карбкатиона. Если продукт этой реакции разбавить водой и осторожно нагревать, он гидролизуется, образуя этанол:
Реакция присоединения серной кислоты к алкенам подчиняется правилу Марковникова:

Реакция с подкисленным раствором перманганата калия
Фиолетовая окраска подкисленного раствора перманганата калия исчезает, если этот раствор встряхивают в смеси с каким-либо алкеном. Происходит гидроксилирование алкена (введение в него гидроксигруппы, образующейся вследствие окисления), который в результате превращается в диол. Например, при встряхивании избыточного количества этилена с подкисленным раствором происходит образование этан-1,2-диола (этиленгликоля)

Если алкен встряхивают с избыточным количеством раствора -ионов, происходит окислительное расщепление алкена, приводящее к образованию альдегидов и кетонов:
Альдегиды, образующиеся при этом, подвергаются дальнейшему окислению с образованием карбоновых кислот.
Гидроксилирование алкенов с образованием диолов может также проводиться с помощью щелочного раствора перманганата калия.
Реакция с пербензойной кислотой
Алкены реагируют с пероксикислотами (надкислотами), например с пербензойной кислотой, образуя простые циклические эфиры (эпоксисоединения). Например

При осторожном нагревании эпоксиэтана с разбавленным раствором какой-либо кислоты образуется этан-1,2-диол:

Реакции с кислородом
Как и все другие углеводороды, алкены горят и при обильном доступе воздуха образуют диоксид углерода и воду:
При ограниченном доступе воздуха горение алкенов приводит к образованию моноксида углерода и воды:
Поскольку алкены имеют более высокое относительное содержание углерода, чем соответствующие алканы, они горят с образованием более дымного пламени. Это обусловлено образованием частиц углерода:
Если смешать какой-либо алкен с кислородом и пропустить эту смесь над поверхностью серебряного катализатора, при температуре около 200 °С образуется эпоксиэтан:
Озонолиз
При пропускании газообразного озона через раствор какого-либо алкена в трихлорометане или тетрахлорометане при температуре ниже 20 °С образуется озонид соответствующего алкена (оксиран)

Озониды - неустойчивые соединения и могут быть взрывоопасными. Они подвергаются гидролизу с образованием альдегидов или кетонов. Например

В этом случае часть метаналя (формальдегида) реагирует с пероксидом водорода, образуя метановую (муравьиную) кислоту:
Полимеризация
Простейшие алкены могут полимеризоваться с образованием высокомолекулярных соединений, которые обладают той же эмпирической формулой, что и исходный алкен:
Эта реакция протекает при высоком давлении, температуре 120°С и в присутствии кислорода, который играет роль катализатора. Однако полимеризацию этилена можно проводить и при более низком давлении, если воспользоваться катализатором Циглера. Одним из наиболее распространенных катализаторов Циглера является смесь триэтилалюминия и тетрахлорида титана.
Полимеризация алкенов более подробно рассматривается в разд. 18.3.
Алкены - непредельные углеводороды, в составе которых есть одна двойная связь. Примеры алкенов:

Методы получения алкенов.
1. Крекинг алканов при 400-700°С. Реакция идет по свободнорадикальному механизму:

2. Дегидрирование алканов:
3. Реакция элиминирования (отщепление): от соседних атомов углерода отщепляются 2 атома или 2 группы атомов, и образуется двойная связь. К таким реакциям относят:
А) Дегидратацию спиртов (нагрев свыше 150°С, при участии серной кислоты , как водоотнимающего реагента):
Б) Отщепление галогенводородов при воздействии спиртового раствора щелочи:

Атом водорода отщепляется преимущественно от того атома углерода, который связан с меньшим числом атомов водорода (наименее гидрогенизированного атома) - правило Зайцева .
В) Дегалогенирование:

Химические свойства алкенов.
Свойства алкенов обуславливаются наличием кратной связи, поэтому алкены вступают в реакции электрофильного присоединения, которое протекает в несколько стадий (Н-Х - реагент):
1-я стадия:

2-я стадия:
 .
.
Ион водорода в такого типа реакциях принадлежит тому атому углерода, который имеет более отрицательный заряд. Распределение плотности такое:

Если в качестве заместителя стоит донор, который проявляется +I- эффект, то электронная плотность смещается в сторону наиболее гидрогенизированного атома углерода, создавая на нем частично отрицательный заряд. Реакции идут по правилу Марковникова : при присоединении полярных молекул типа НХ (HCl , HCN , HOH и т.д.) к несимметричным алкенам водород присоединяется преимущественно к более гидрогенизированому атому углерода при двойной связи.
А) Реакции присоединения:
1) Гидрогалогенирование:
Реакция идет по правилу Марковникова. Но если в реакции присутствует пероксид , то правило не учитывается:
2) Гидратация. Реакция идет по правилу Марковникова в присутствие фосфорной или серной кислоты :

3) Галогенирование. В результате происходит обесцвечивание бромной воды - это качественная реакция на кратную связь:
4) Гидрирование. Реакция протекает в присутствие катализаторов.
АЛКЕНЫ
Углеводороды, в молекуле которых помимо простых σ-связей углерод - углерод и углерод - водород имеются углерод-углеродные π-связи, называются непредельными. Так как образование π-связи формально эквивалентно потере молекулой двух атомов водорода, то непредельные углеводороды содержат на 2п атомов водорода меньше, чем предельные, где п - число π -связей:
Ряд, члены которого отличаются друг от друга на (2Н) n , называется изологическим рядом. Так, в приведенной выше схеме изологами являются гексаны, гексены, гексадиены, гексины, гексатриены и т. д.
Углеводороды, содержащие одну π-связь (т. е. двойную связь), называются алкенами (олефинами) или, по первому члену ряда - этилену, этиленовыми углеводородами. Общая формула их гомологического ряда С п Н 2л.
1. Номенклатура
В соответствии с правилами ИЮПАК при построении названий алкенов наиболее длинная углеродная цепь, содержащая двойную связь, получает название соответствующего алкана, в котором окончание -ан заменено на -ен. Эта цепь нумеруется таким образом, чтобы углеродные атомы, участвующие в образовании двойной связи, получили номера, наименьшие из возможных:

Радикалы называются и нумеруются как и в случае алканов.
Для алкенов сравнительно простого строения разрешается применять более простые названия. Так, некоторые наиболее часто встречающиеся алкены называют, добавляя суффикс -ен к названию углеводородного радикала с тем же углеродным скелетом:
Углеводородные радикалы, образованные из алкенов, получают суффикс -енил. Нумерация в радикале начинается от углеродного атома, имеющего свободную валентность. Однако для простейших алкенильных радикалов вместо систематических названий разрешается использовать тривиальные:

Водородные атомы, непосредственно связанные с ненасыщенными атомами углерода, образующими двойную связь, часто называют винилъными атомами водорода,
2. Изомерия
Помимо изомерии углеродного скелета, в ряду алкенов появляется еще и изомерия положения двойной связи. В общем виде изомерия такого типа - изомерия положения заместителя (функции) - наблюдается во всех случаях, когда в молекуле имеются какие-либо функциональные группы. Для алкана С 4 Н 10 возможны два структурных изомера:
Для алкена С 4 Н 8 (бутена) возможны три изомера:

Бутен-1 и бутен-2 являются изомерами положения функции (в данном случае ее роль выполняет двойная связь).
Пространственные изомеры различаются пространственным расположением заместителей относительно друг друга и называются цис-изомерами, если заместители расположены по одну сторону от двойной связи, и транс-изомерами, если по разные стороны:

3. Строение двойной связи
Энергия разрыва молекулы по двойной связи С=С равна 611 кДж/моль; так как энергия σ-связи С-С равна 339 кДж/моль, то энергия разрыва π -связи равна лишь 611-339 = 272 кДж/моль. π -электроны значительно легче σ -электронов поддаются влиянию, например, поляризующих растворителей или воздействию любых атакующих реагентов. Это объясняется различием в симметрии распределения электронного облака σ- и π-электронов. Максимальное перекрывание р-орбиталей и, следовательно, минимальная свободная энергия молекулы реализуются лишь при плоском строении винильного фрагмента и при укороченном расстоянии С-С, равном 0,134нм, т.е. значительно меньшем, чем расстояние между углеродными атомами, связанными простой связью (0,154 нм). С поворотом «половинок» молекулы относительно друг друга по оси двойной связи степень перекрывания орбиталей снижается, что связано с затратой энергии. Следствием этого является отсутствие свободного вращения по оси двойной связи и существование геометрических изомеров при соответствующем замещении у атомов углерода.
Как и алканы, низшие гомологи ряда простейших алкенов при обычных условиях - газы, а начиная с С 5 - низкокипящие жидкости.

Все алкены, как и алканы, практически нерастворимы в воде и хорошо растворимы в других органических растворителях, за исключением метилового спирта; все они имеют меньшую плотность, чем вода.
5. Химические свойства
При рассмотрении реакционной способности сложных органических соединений действует общий принцип. В большинстве реакций участвует не «инертный» углеводородный радикал, а имеющиеся функциональные группы и их ближайшее окружение. Это естественно, ибо большинство связей менее прочны, чем связи С-С и С-Н, и, кроме того, связи в функциональной группе и вблизи нее наиболее поляризованы.
Естественно ожидать, что реакции алкенов будут проходить по двойной связи, которую тоже можно считать функциональной группой, а следовательно, будут реакциями присоединения, а не реакциями замещения, характерными для ранее рассмотренных алканов.
Присоединение водорода
Присоединение водорода к алкенам приводит к образованию алканов:
Присоединение водорода к этиленовым соединениям в отсутствие катализаторов происходит лишь при высоких температурах, при которых часто начинается разложение органических веществ. Значительно легче присоединение водорода идет в присутствии катализаторов. Катализаторами служат металлы платиновой группы в мелкодисперсном состоянии, сама платина и особенно палладий - уже при обычной температуре. Большое практическое значение имело открытие Сабатье, применившего специально приготовленный мелкораздробленный никель при температуре 150-300°С и в многочисленных работах показавшего универсальность этого катализатора для целого ряда реакций восстановления.
Присоединение галогенов
Галогены присоединяются к алкенам с образованием дигалогенопроизводных, содержащих атомы галогена у соседних атомов углерода:

На первой стадии этой реакции происходит взаимодействие между π-электронами двойной связи и электрофильной частицей галогена с образованием π-комплекса (I). Далее π-комплекс перегруппировывается в ониевый (бромониевый) ион (II) с ощеплением аниона галогена, находящийся в равновесии с карбкатионом (III). Затем анион атакует ониевый ион с образованием продукта присоединения (IV):

Атака анионом бромониевого иона (II) с образованием дибромида (IV) происходит в транс-положение. Так, в случае присоединения Вг 2 к циклопентену образуется только транс-1,2-дибромдикло-пентан:

Доказательством двухстадийного присоединения галогена к алкенам является тот факт, что при присоединении Вг 2 к циклогексену в присутствии МаС1 образуется не только транс-1,2-дибромциклогексан, но и транс-1-бром-2-хлорциклогексан:

Радикальное галогенирование
В жестких условиях (газовая фаза, 500°С) галогены не присоединяются по двойной связи, а происходит галогенирование α-положения:
В этом случае реакция идет по радикальному механизму.
Присоединение галогеноводородов
Галогеноводороды присоединяются к алкенам с образованием галогеналкилов. Присоединение в случае несимметричных молекул идет по правилу Марковникова, т. е. водород присоединяется к наиболее гидрогенизированному атому углерода (с наибольшим числом водородных атомов):
Эта реакция, как и присоединение брома к этилену, идет после образования π-комплекса через стадию образования протониевого иона:

В присутствии перекисей бромоводород присоединяется не по правилу Марковникова (эффект Хараша):
В присутствии перекисей реакция идет не по механизму электрофильного присоединения, как выше, а по радикальному механизму. Первой стадией является атака перекисного радикала на молекулу НВг:
Возникший радикал брома присоединяется к пропилену с образованием нового радикала:

Последний стабилизируется за счет вырывания водорода из новой молекулы НВг с регенерацией нового радикала брома и т. д.:
И в этом случае направление процесса определяется устойчивостью радикалов бромпропана: образуется преимущественно более устойчивый, приводя к 1-бромпропану.
Присоединение воды и серной кислоты
В присутствии кислот вода присоединяется по двойной связи по правилу Марковникова:
Так же идет реакция и с серной кислотой:
Окисление перманганатом калия в нейтральной или слабощелочной среде (реакция Вагнера)
На первой стадии по механизму цис-присоединения идет присоединение иона МпО 4 к кратной связи с последующим гидролитическим расщеплением неустойчивого продукта присоединения и выделения иона МпО 3 -

Реакция идет по схеме цис-присоединения:

Кислые растворы перманганата окисляют алкены с разрывом цепи по С=С-связи и образованием кислот или кетонов:
Действие озона на алкены
Эта реакция приводит к кристаллическим сильновзрывчатым озонидам, которые при гидролизе образуют альдегиды или кетоны:

Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
Реакция идет путем цис-циклоприсоединения через стадию неустойчивого мольозонида, который подвергается диссоциации и последующей рекомбинации:

Полимеризация алкенов
Особо важное значение получила полимеризация этилена и пропилена в полимеры с молекулярной массой около 10 5 . До 1953 г. в основном применялась радикальная (инициируемая свободными радикалами) полимеризация, хотя в принципе использовалось и анионное, и катионное инициирование процесса.
После работ Циглера и Натта, которые получили Нобелевскую премию за эти исследования, наиболее широко стала использоваться так называемая координационная полимеризация. Простейший «циглеровский» катализатор этого типа состоит из триэтилалюминия и соединений титана (IV). При этом происходит образование полимеров с высокой степенью стереорегулярности. Например, при полимеризации пропилена образуется изотактический полипропилен - полимер, в котором все боковые СН 3 -группы занимают одинаковое пространственное положение:

Это придает полимеру большую прочность, и он может даже применяться для изготовления синтетического волокна.
Полиэтилен, получаемый этим способом, представляет собой предельный углеводород с неразветвленной цепью. Он менее эластичен, чем полиэтилен, получаемый при высоких давлениях, но обладает большей твердостью и способен выдерживать воздействие более высоких температур.
Благодаря сочетанию многих ценных свойств полиэтилен имеет очень широкое применение. Он является одним из лучших материалов для изоляции кабелей, для применения в радарной технике, радиотехнике, сельском хозяйстве и др. Из него изготавливают трубы, шланги, сосуды, тару для сельскохозяйственных продуктов и удобрений, пленки различной толщины и многие бытовые предметы. Прочные пленки из полиэтилена начали применяться даже в качестве покрытия дна искусственных каналов для придания им водонепроницаемости.
Теломеризация
Интересен имеющий промышленное применение процесс сополимеризации этилена с тетрахлоридом углерода, названный теломеризацией. Если в смесь этилена с СС1 4 внести перекись бензоила или другой инициатор, распадающийся с образованием свободных радикалов, происходит следующий процесс:
Радикалы СС1 3 " инициируют цепную полимеризацию этилена:
При встрече с другой молекулой СС1 4 рост цепи прекращается:
Радикал СС1 3 - дает начало новой цепи.
Образующиеся низкомолекулярные продукты полимеризации, содержащие на концах цепи атомы галогена, называются теломерами. Получены теломеры со значениями п =2,3, 4, ...,15.
При гидролизе продуктов теломеризации образуются ω-хлорзаме-щенные карбоновые кислоты, являющиеся ценными химическими продуктами.
Для алкенов характерны, прежде всего, реакции присоединения по двойной связи. В основном эти реакции идут по ионному механизму. Пи-связь разрывается, и образуются две новые сигма-связи. Напомню, что для алканов типичными были реакции замещения и шли они по радикальному механизму. Присоединяться к алкенам могут молекулы водорода, эти реакции называются гидрирование, молекулы воды, гидратация, галогены галогенирование, галогенводороды гидрогалогенирование. Но обо всем по порядку.
Реакции присоединения по двойной связи
Итак, первое химическое свойство способность присоединять галогеноводороды, гидрогалогенирование.
Пропен и остальные алкены реагируют с галогеноводородами по правилу Марковникова.

Атом водорода присоединяется к наиболее гидрированному, или правильнее сказать гидрогенизированному, атому углерода.
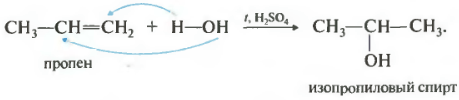
Вторым номером в нашем списке свойств будет гидратация, присоединение воды.
Реакция проходит при нагревании в присутствии кислоты обычно серной или фосфорной. Присоединение воды происходит также по правилу Марковникова, то есть первичный спирт можно получить только гидратацией этилена, остальные неразветвленные алкены дают вторичные спирты.
И для гидрогалогениерования и для гидратации существуют исключения из правила Марковникова. Во-первых, против этого правила присоединение протекает в присутствии пероксидов.
Во-вторых, для производных алкенов, в которых присуствуют электронноакцепторне группы. Например, для 3,3,3-трифторпропена-1.

Атомы фтора за счет высокой электроотрицательности оттягивают на себя электронную плотность по цепи сигма-связей. Такое явление называется отрицательным индуктивным эффектом.

Из-за этого происходит смещение подвижных пи-электронов двойной связи и у крайнего атома углерода оказывается частичный положительный заряд, который обычно обозначается как дельта плюс. Именно к нему и пойдет отрицательно заряженный ион брома, а катион водорода присоединится к наименее гидрированному атому углерода.
Помимо трифторметильной группы отрицательным индуктивным эффектом обладает, например, трихлорметильная группа, нитрогруппа, карбоксильная группа и некоторые другие.
Этот второй случай нарушения правила Марковникова в ЕГЭ встречается очень редко, но все-таки желательно иметь его в виду, если вы планируете сдать экзамен на максимальный балл.
Третье химическое свойство присоединение молекул галогенов.

В первую очередь это касается брома, поскольку данная реакция является качественной на кратную связь. При пропускании, например, этилена через бромную воду, то есть раствор брома в воде, имеющий коричневый цвет, происходит ее обесцвечивание. Если пропускать через бромную воду смесь газов, например, этан и этен, то можно получить чистый этан без примеси этена, поскольку тот останется в реакционной колбе в виде дибромэтана, представляющего собой жидкость.
Особым образом стоит отметить реакцию алкенов в газовой фазе при сильном нагревании, например, с хлором.
При таких условиях протекает не реакция присоединения, а реакция замещения. При чем исключительно по альфа-атому углерода, то есть атому, соседствующему с двойной связью. В данном случае получается 3-хлорпропен-1. Эти реакции на экзамене встречаются нечасто, поэтому большинство учеников их не помнит и, как правило, совершает ошибки.
Четвертым номером идет реакция гидрирования, а вместе с ней и реакция дегидрирования. То есть присоединение или отщепление водорода.

Гидрирование происходит при не очень высокой температуре на никелевом катализаторе. При более высокой температуре возможно дегидрирование с получением алкинов.
Пятым свойством алкенов является способность к полимеризации, когда сотни и тысячи молекул алкена за счет разрыва пи-связи и образования сигма-свзяей друг с другом образуют очень длинные и прочные цепочки.
В данном случае получился полиэтилен. Обратите внимание, что в получившейся молекуле кратные связи отсутствуют. Такие вещества называются полимерами, исходные молекулы называются мономерами, повторяющийся фрагмент это элементарное звено полимера, а число n степень полимеризации.
Также возможны реакции получения других важных полимерных материалов, например, полипропилена.


Еще один важный полимер поливинилхлорид.

Исходным веществом для производства этого полимера является хлорэтен, тривиальное название которого винилхлорид. Поскольку этот непредельный заместитель называется винил. Часто встречающаяся аббревиатура на пластмассовых изделиях ПВХ как раз расшифровывается как поливинилхлорид.
Мы обсудили пять свойств, которые представляли собой реакции присоединения по двойной связи. Теперь обратимся к реакциям окисления .
Реакции окисления алкенов
Шестое химическое свойство в нашем общем списке это мягкое окисление или реакция Вагнера. Оно протекает при воздействии на алкен водным раствором перманганата калия на холоду, поэтому часто в экзаменационных заданиях указывают температуру ноль градусов.
В результате получается двухатомный спирт. В данном случае этиленгликоль, а в целом такие спирты носят общее название гликоли. В процессе реакции фиолетово-розовый раствор перманганата обесцвечивается, поэтому эта реакция также является качественной на двойную связь. Марганец в нейтральной среде из степени окисления +7 восстанавливается до степени окисления +4. Рассмотрим еще несколько примеров. УРАВНЕНИЕ
Здесь получился пропандиол-1,2. Однако таким же образом будут реагировать и циклические алкены. УРАВНЕНИЕ
Еще один вариант, когда двойная связь находится, например, в боковой цепи ароматических углеводородов. Регулярно в заданиях егэ встречается реакция Вагнера с участием стирола, его второе название винилбензол.

Я надеюсь, что представил вашему вниманию достаточно примеров, чтобы вы поняли, что мягкое окисление двойной связи всегда подчиняется довольно простому правилу пи-связь разрывается и к каждому атому углерода присоединяется гидроксигруппа.
Теперь, что касается жесткого окисления. Это будет наше седьмое свойство. Такое окисление происходит, когда алкен реагирует с кислотным раствором перманганата калия при нагревании.
Происходит деструкция молекулы, то есть ее разрушение по двойной связи. В случае бутена-2 получились две молекулы уксусной кислоты. В целом же, по продуктам окисления можно судить о положении кратной связи в углеродной цепи.
При окислении бутена-1 получается молекула пропионовой (пропановой) кислоты и углекислый газ.
В случае этилена получится две молекулы углекислого газа. Во всех случаях в кислой среде марганец из степени окисления +7 восстанавливается до +2.
И, наконец, восьмое свойство полное окисление или горение.
Алкены сгорают, как и другие углеводороды, до углекислого газа и воды. Запишем уравнение сгорания алкенов в общем виде.
Молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле алкена, поскольку в состав молекулы CO 2 входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа плюс n из воды, итого 3n. Слева атомов кислорода столько же, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть 3n/2 молекул кислорода. Можно записать 1,5n.
Мы рассмотрели восемь химических свойств алкенов.
